【Adv.Mater.】 颠覆性癌症疫苗问世!纳米机器人在淋巴结“变身”后,T细胞激活率暴涨81.9%,肿瘤抑制率高达92.3%!
✨文章标题:Proton-Driven Deformability Enables Nanozyme-Integrated Vaccine for Enhanced Tumor Immunotherapy ✉️作者: Xiyun Yan, Bing Jiang等 📚期刊:Advanced Materials 🔗链接:https://doi.org/10.1002/adma.202509994
癌症,一个横亘在人类面前的“终极难题”,其复杂性和高致死率始终是我们心头沉重的阴影。尽管免疫疗法,尤其是基于疫苗的方法,已被视为实现长期肿瘤消退和转移预防的“明日之星” ,但要设计出真正有效的癌症疫苗,其挑战如同在纳米尺度上搭建一座精密时钟 。
🔬 从“痛点”到“突破”:传统疫苗的困境与纳米科技的解答
传统的癌症疫苗为什么不给力?
传统的亚单位疫苗(Subunit vaccines),虽然以其高安全性和低副作用而备受青睐,但在临床上却常常“水土不服” 。究其原因,主要有三大“拦路虎”:
快速清退和降解: 疫苗中的抗原和佐剂在体内很快被清除或降解,还没来得及抵达“战场”——淋巴结(LNs)就失效了 。
靶向效率低下: 淋巴结是富集树突状细胞(DCs)和T细胞的关键免疫器官 ,但传统疫苗很难高效、精准地到达这里并长时间驻留 。
“无感”免疫反应: 疫苗诱导的细胞免疫,尤其是负责直接杀伤肿瘤细胞的细胞毒性CD8+ T淋巴细胞(CTLs)激活能力不足,导致抗肿瘤效果不佳 。
想象一下,你派出了一个小型“快递员”去送一个重要的包裹(抗原)到免疫细胞的“中央枢纽”(淋巴结),但这个快递员不仅跑得太快,还会在半路把包裹弄丢,更糟糕的是,即便送到了,收货人(DCs)也不觉得这是个“紧急”包裹,自然就不会全力启动免疫防卫系统 。
动态自适应纳米疫苗的“神来之笔”
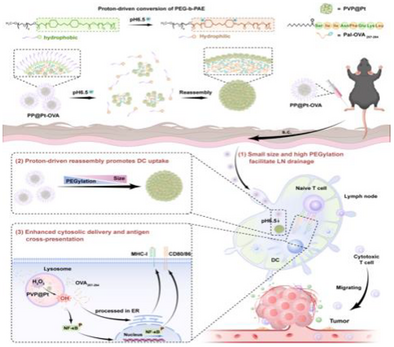
为了解决这个“纳米级悖论”,来自郑州大学和中科院生物物理研究所等机构的研究团队,巧妙地设计出了一种 “质子驱动、多功能、智能形态调控的纳米疫苗”,简称 PP@Pt-OVA 。
这个设计堪称一次“动态、智能、多功能”的纳米疫苗策略的集大成者 。它整合了两种核心创新:
智能形态调控(变身): 利用淋巴结微环境的弱酸性(),让纳米颗粒能够根据环境变化,动态调整自己的尺寸和表面特性。
纳米酶催化(催化佐剂): 将具有催化活性的PVP@Pt纳米酶集成到疫苗中,充当“超级佐剂”,在DC细胞内“自启动”,增强免疫激活 。
PP@Pt-OVA的出现,旨在同时攻克高效淋巴结递送和强大细胞免疫激活的两大难题,为癌症免疫疗法开辟了新的道路 。
⚙️ 核心方法与技术细节解密:纳米机器人的“变身”与“自毁”机制
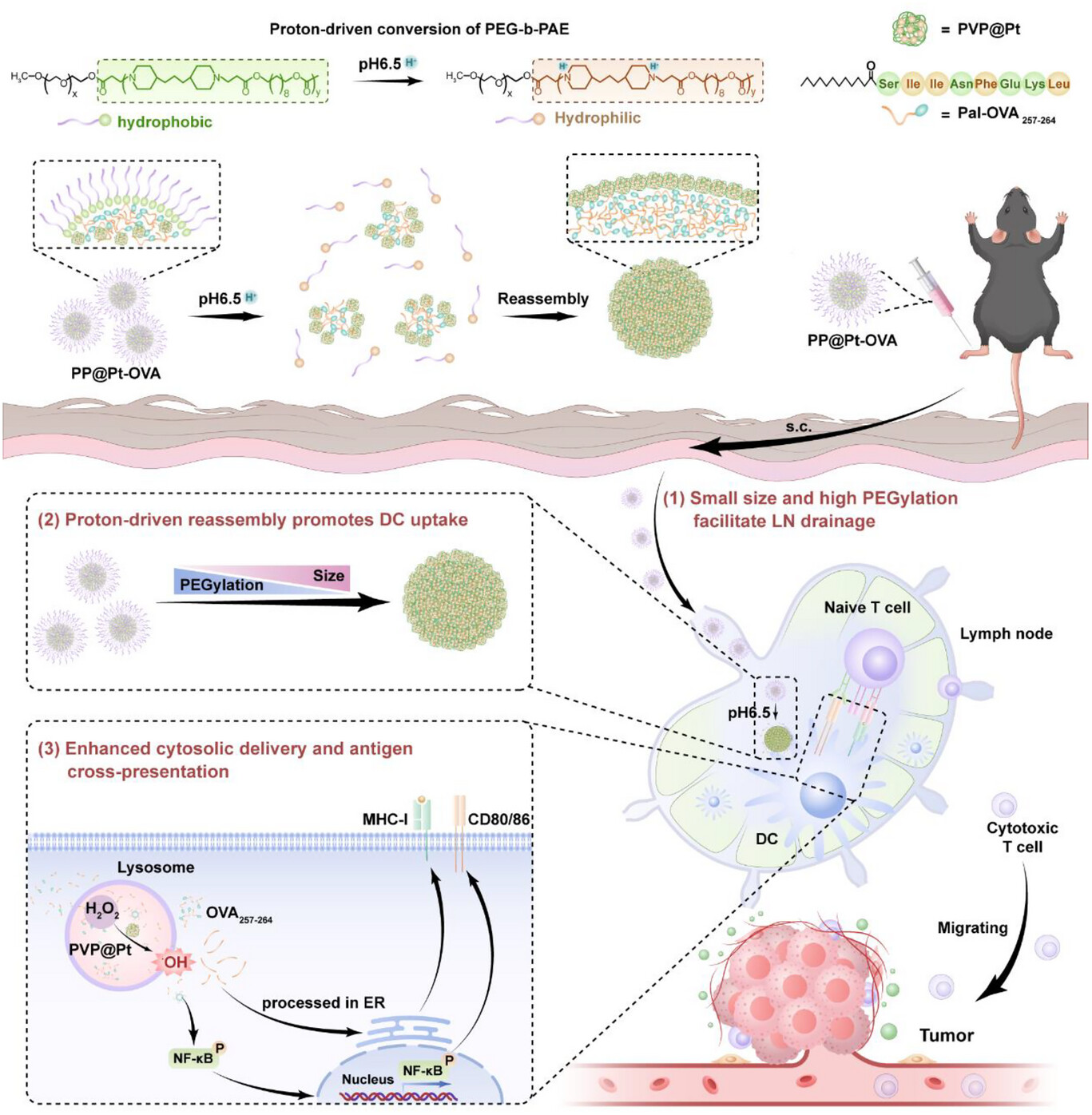
PP@Pt-OVA纳米疫苗的“智能”之处,体现在其精密的结构和对微环境的完美响应上 。它主要由三部分构成 :
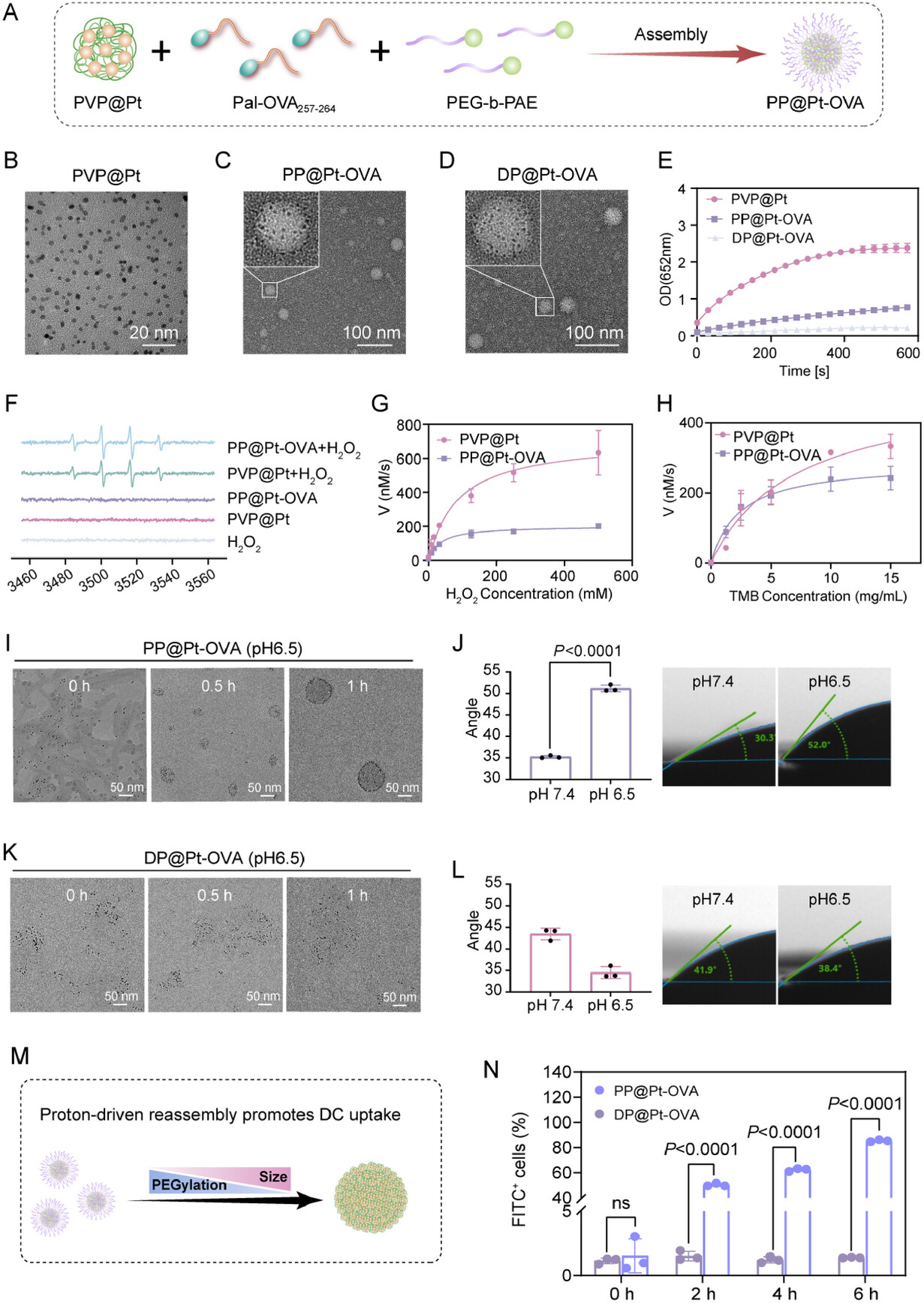
核心功能模块:PVP@Pt纳米酶。这是一种铂纳米酶,像一个微型“催化器”,能将细胞内的内源性过氧化氢()催化转化为剧毒的羟基自由基 () 。
抗原载荷:肽段。这是作为肿瘤抗原的标志物,被棕榈酸(Pal)修饰以提高其疏水性,便于包裹 。
智能外壳:PEG-b-PAE胶束。这是整个系统的“变身衣”,是一种聚乙二醇-聚(-氨基酯)两亲性共聚物 。
第一步:纳米机器人的“潜行模式” (Lymph Node Targeting)
当PP@Pt-OVA通过皮下注射进入体内时,它首先处于“潜行模式”:小尺寸(<50 nm)和高PEGylation(聚乙二醇修饰) 状态 。
小尺寸: 像一个轻便的侦察兵,可以高效地通过淋巴管引流进入淋巴结 。
高PEGylation: 相当于穿上了一层“隐身衣”,提高了纳米颗粒在血液循环和淋巴液中的稳定性 。
在这一阶段,高PEGylation虽然有利于引流,但却会阻碍免疫细胞(DCs)的识别和摄取 。这就是传统纳米疫苗的“两难困境” 。
第二步:淋巴结内的“变身激活” (Morphology Transformation)
当PP@Pt-OVA成功引流到淋巴结后,它遭遇了弱酸性()的微环境 。此时,智能外壳PEG-b-PAE开始发生“质子驱动的形态转换” :
PAE质子化: 弱酸性环境触发PAE聚合物的质子化,导致PEG-b-PAE胶束解体 (disassembly) 。
形态重组: 疏水的OVA肽段开始内聚,将两亲性的PVP@Pt纳米酶“推向”胶束的外围,并发生重新组装 (reassembly) 。
这一“变身”的结果是:
粒径增大: 纳米颗粒由小变大 。
PEGylation降低(脱隐身衣): 胶束解体导致PEG链脱落,表面疏水性显著增加,接触角增加了约71.6% 。
粒径增大和PEGylation降低正是DC细胞高效识别和吞噬所需的特征 。通过这个精妙的“变身”机制,纳米疫苗完美地解决了“高效引流”和“高效摄取”这对矛盾 。
第三步:细胞内的“催化自毁”和“信号放大” (Catalysis and Activation)
被DC细胞内吞后,纳米疫苗进入酸性的溶酶体(Lysosome)微环境()。
抗原释放: 进一步的酸性触发了封装抗原OVA的快速释放(在pH 5.0下,4小时内释放约50%)。
ROS爆发: 释放出的PVP@Pt纳米酶作为催化佐剂,与细胞内源性的反应,高效催化产生羟基自由基 () 。
内体逃逸与交叉呈递: 爆发的具有强大的破坏力,能够破坏溶酶体膜 ,让被释放的抗原肽段()逃逸到细胞质中(Cytosol),这是抗原交叉呈递(Cross-presentation)的关键步骤 。随后,抗原肽才能通过MHC-I分子呈递给CD8+ T细胞 。
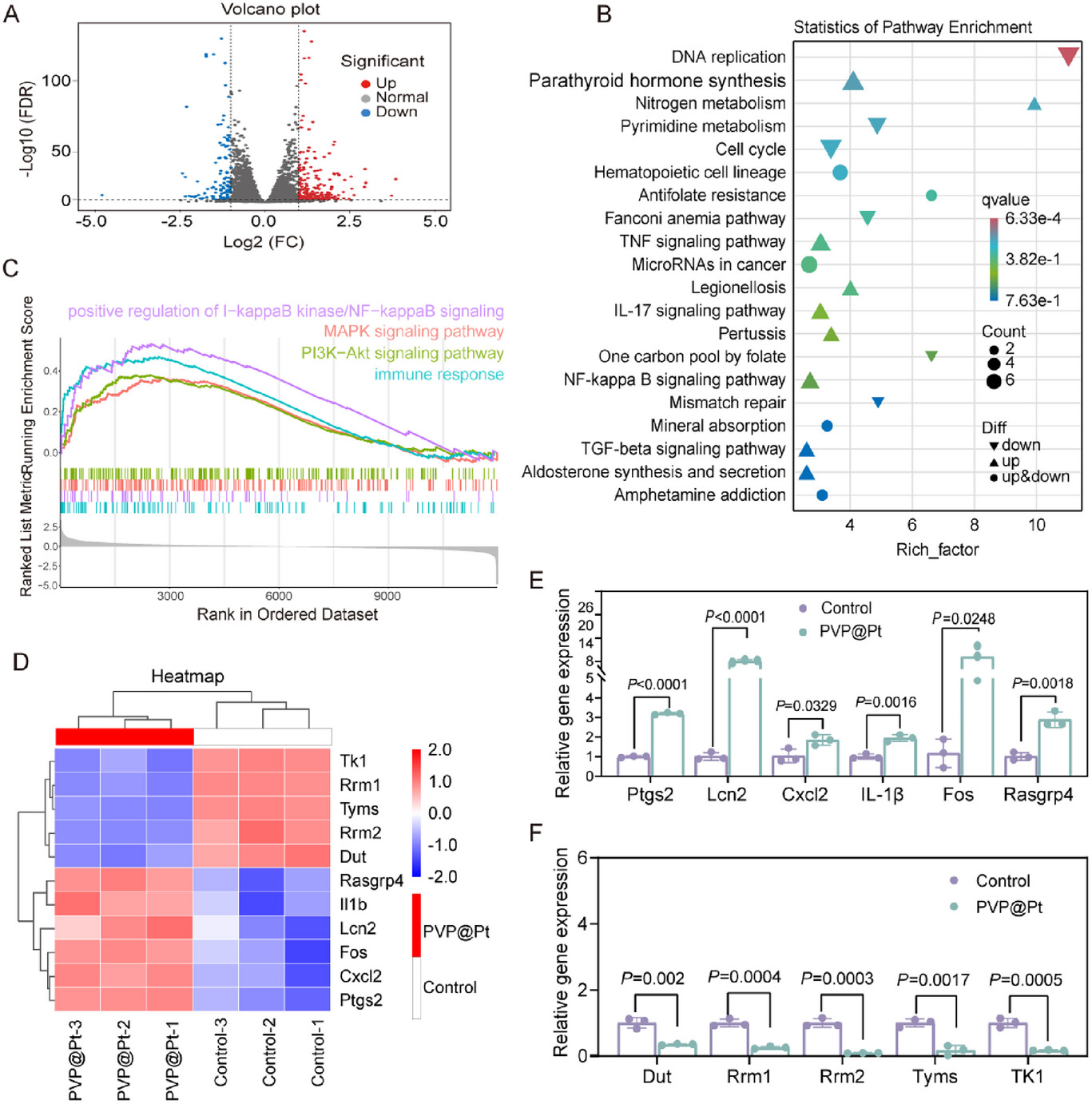
DC成熟信号放大: 的产生还会进一步激活NF-κB(核因子B)、MAPK等关键免疫信号通路 ,促进DC细胞的成熟和共刺激分子(如CD80、CD86、CD69)的表达 。NAC(ROS清除剂)的实验结果直接证明了,ROS的生成是激活NF-κB信号的关键上游步骤 。
通过“潜行、变身、催化、激活”这一系列精密步骤,PP@Pt-OVA实现了高效的抗原递送、强大的DC细胞激活和最终T细胞免疫的全面启动 。
📊 数据背后的创新与颠覆性分析:为什么说PP@Pt-OVA是了不起的成就?
PP@Pt-OVA纳米疫苗的创新性并非空穴来风,而是由一系列令人信服的体内外实验数据所支撑,这些数据有力地证明了其“动态、多功能”设计的优越性。
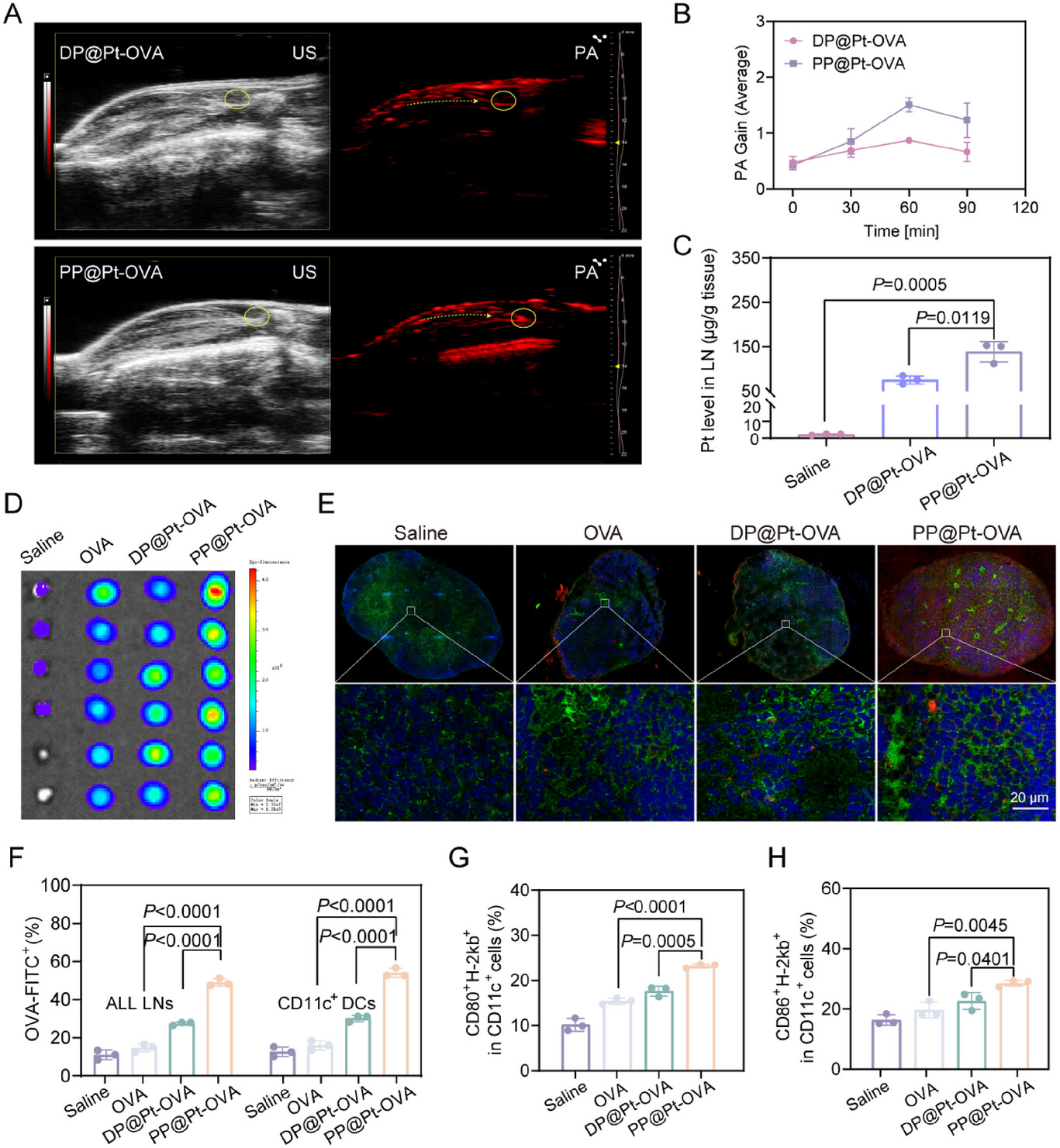
1. 淋巴结靶向与滞留效率:1.83倍的铂元素优势
淋巴结靶向是疫苗成功的首要前提 。研究人员通过光声(PA)成像和电感耦合等离子体原子发射光谱法(ICP-AES)对PP@Pt-OVA在淋巴结中的积累进行了量化 。
高效靶向: 相比于以静态形态存在的对照组DP@Pt-OVA,PP@Pt-OVA在淋巴结中的Pt含量高出约1.83倍(分别为组织 vs. 组织)。
持续滞留: PA信号显示,PP@Pt-OVA在淋巴结中的信号峰值(1.403)比DP@Pt-OVA高出约1.65倍 ,这直接印证了“质子驱动变身”策略成功地实现了高效引流后的增强滞留 。
2. 树突状细胞(DC)摄取与成熟度:激活率“狂飙”81.9%
DC细胞是免疫反应的“指挥官”,疫苗能否被它们高效摄取并激活,至关重要 。
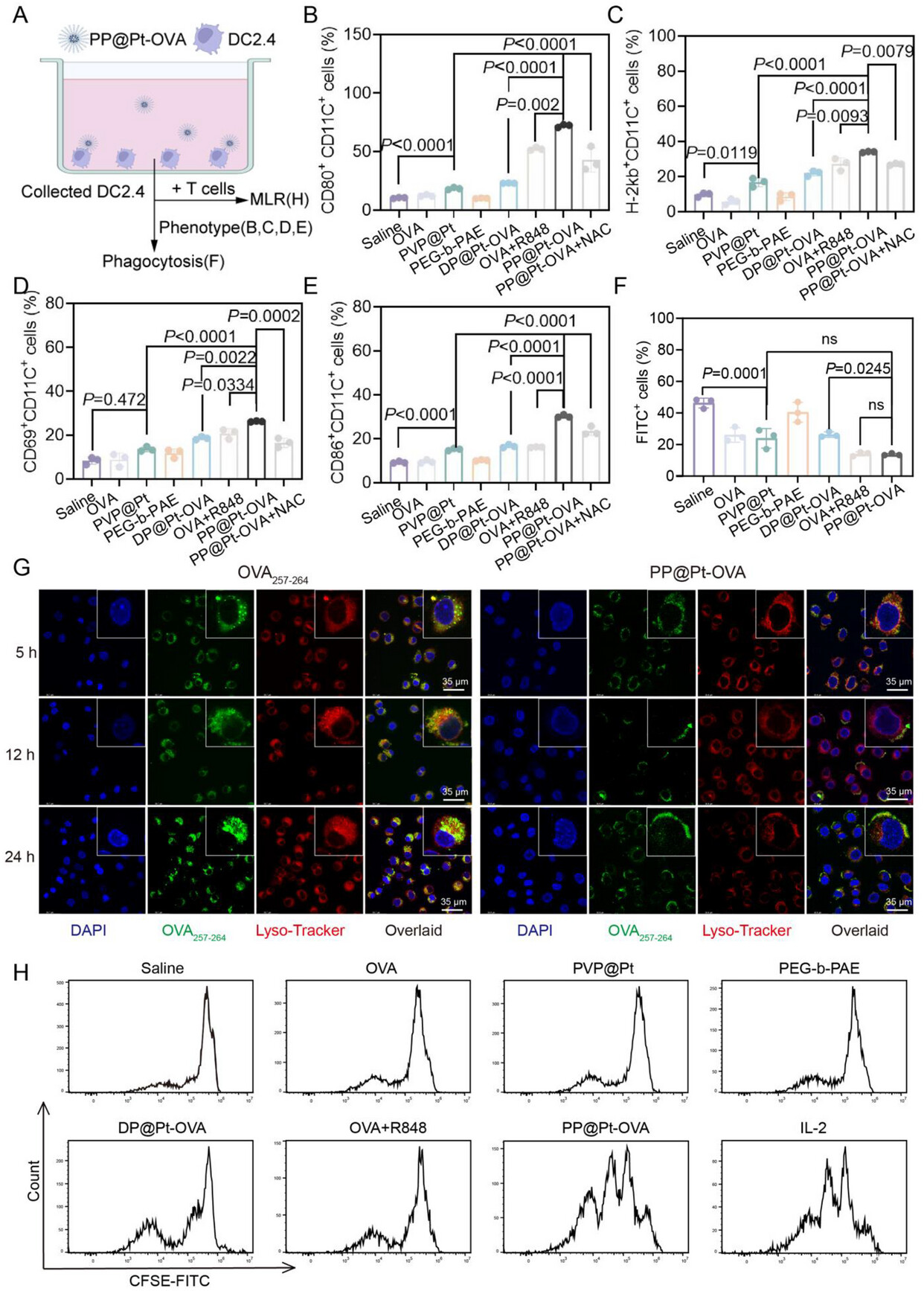
DC摄取效率暴增
- 体外实验: 在模拟淋巴结微酸环境(pH 6.5)处理后,PP@Pt-OVA的DC细胞摄取效率在6小时时比对照组DP@Pt-OVA高出83.97% ,这直接归功于其粒径增大和去PEG化后的表面疏水性增强 。
DC成熟度显著提升
体内实验: 在体内免疫后,PP@Pt-OVA组淋巴结内表达共刺激分子(标志着DC成熟)的DC细胞比例遥遥领先 。
相比于生理盐水组,PP@Pt-OVA组中**和(标志着DC成熟和抗原呈递)的DC细胞比例分别高出81.9%和77.1%** 。
相比于静态纳米疫苗DP@Pt-OVA,PP@Pt-OVA组的和细胞比例在预防性模型中分别高出约44%和32.3% 。
这些数据清晰地表明,质子驱动的“变身”策略与纳米酶的催化佐剂作用形成了强大的协同效应,使得PP@Pt-OVA在DC摄取和激活方面达到了新的高度 。
3. 细胞毒性T淋巴细胞(CTL)激活:最强T细胞增殖与记忆
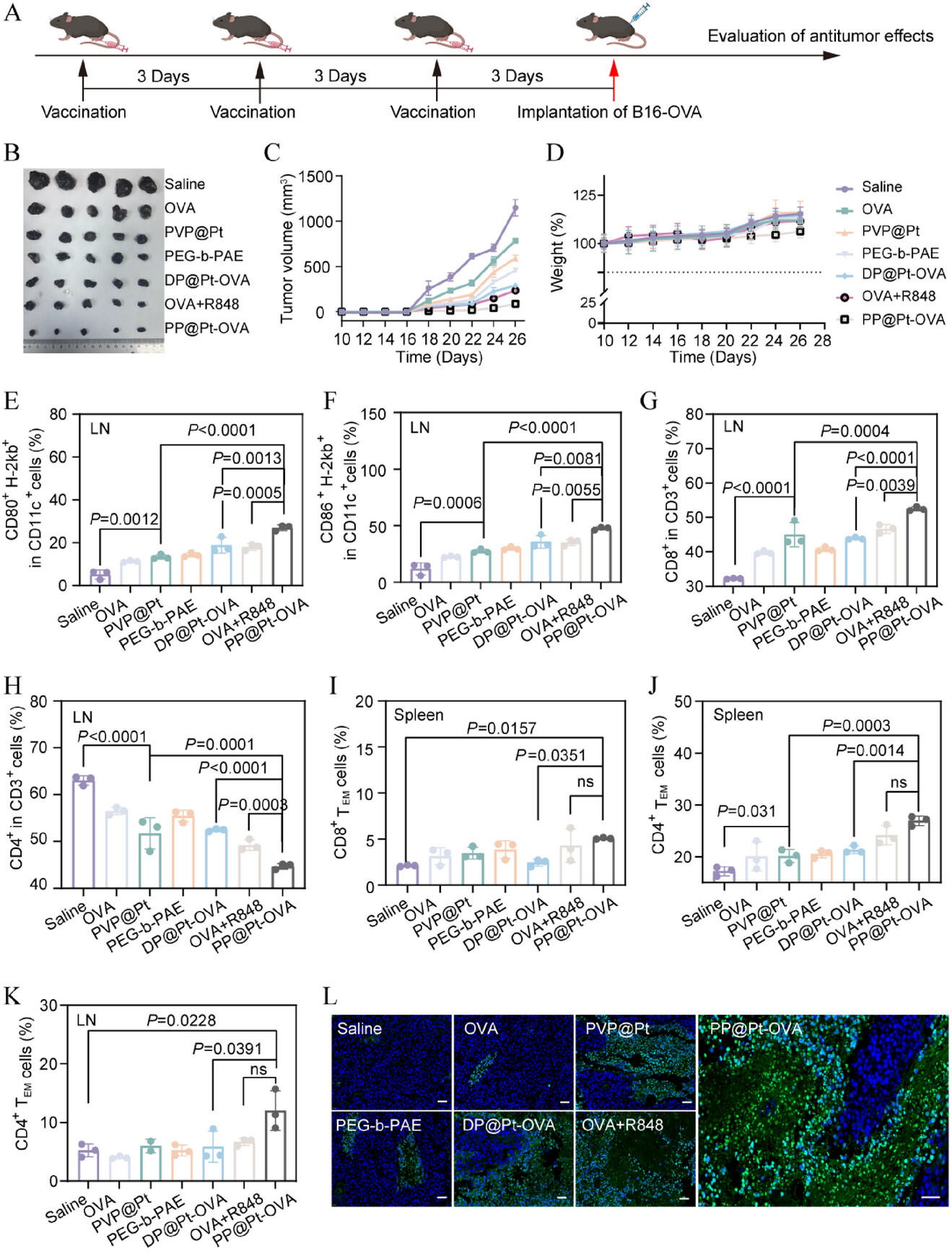
强大的CD8+ T细胞反应是有效抗肿瘤免疫的关键 。
体外T细胞增殖: 在体外,经PP@Pt-OVA处理的DC细胞诱导的T细胞增殖能力最强,甚至超越了经典的IL-2刺激对照组 。这证实了PP@Pt-OVA能最有效地激发抗原交叉呈递和T细胞反应 。
体内CTL激活: 在体内预防性肿瘤模型中,PP@Pt-OVA免疫的小鼠淋巴结中的 T细胞比例显著高于DP@Pt-OVA组(约1.2倍)。
免疫记忆细胞: 预防性免疫后,PP@Pt-OVA组在脾脏中诱导的 效应记忆T细胞()比例比DP@Pt-OVA组高出2.1倍 [cite: 989],淋巴结中的 细胞比例高出2.05倍 。这预示着该疫苗能够建立更持久、更强大的保护性细胞免疫记忆 。
4. 整体抗肿瘤疗效:肿瘤抑制率高达92.3%
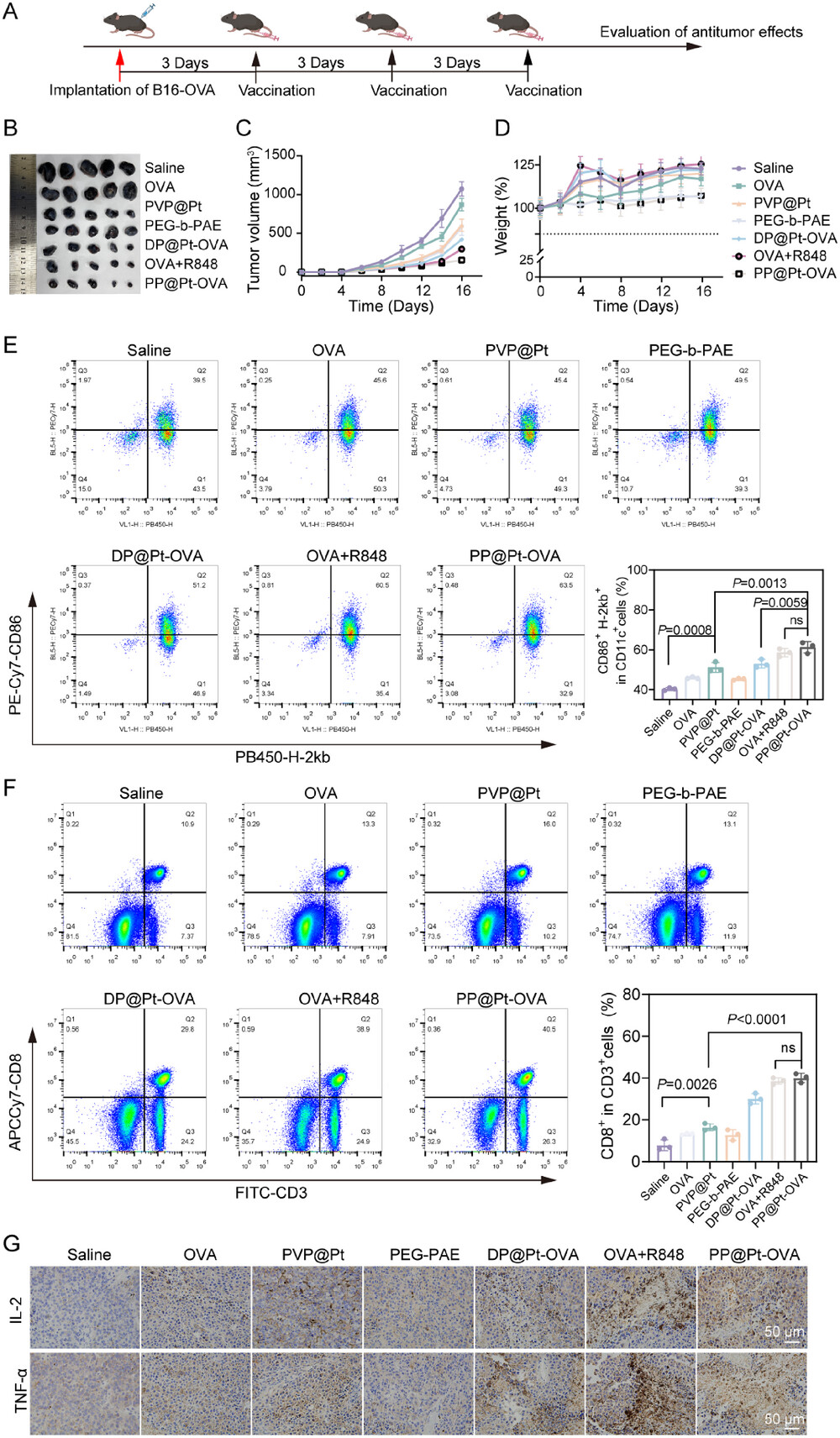
PP@Pt-OVA在小鼠黑色素瘤模型中展现了令人惊叹的抗肿瘤效果:
预防性模型(Prophylactic Model)
在接种肿瘤前预先免疫的预防性模型中,PP@Pt-OVA组表现出最强劲的肿瘤抑制效果,肿瘤抑制率高达92.3% ,显著优于游离OVA组(31.6%)和PVP@Pt组(48.5%)。
治疗性模型(Therapeutic Model)
在已有肿瘤后再进行免疫的治疗性模型中,PP@Pt-OVA同样表现出色,肿瘤抑制率达到85.5% ,远高于游离OVA组的有限抑制 。
肿瘤微环境改善: 在治疗性模型中,PP@Pt-OVA显著增加了肿瘤组织中** T细胞的浸润**,并使细胞毒性T淋巴细胞(CTL)的标志物 T细胞水平最高 。
逆转免疫抑制: PP@Pt-OVA还能显著逆转肿瘤微环境中的免疫抑制状态,使肿瘤浸润的调节性T细胞(Tregs)频率从生理盐水组的约22.51%降低到约7.43%,并减少髓系抑制性细胞(MDSCs)的积累 。同时,它提高了IL-2和TNF-等关键细胞因子的表达 ,营造了一个强大的抗肿瘤免疫环境 。
总而言之,PP@Pt-OVA纳米疫苗通过精妙的“质子驱动变身”策略解决了纳米载体设计中的核心矛盾,并利用纳米酶的催化活性实现了DC细胞的强效激活和抗原的高效呈递,最终在体内引发了前所未有的强大、持久的细胞免疫反应和显著的肿瘤抑制效果 。
🧭 应用展望、局限性与未来路线图
PP@Pt-OVA的成功设计,不仅为癌症免疫疗法带来了一款“多功能、智能”的强大工具,更提供了一个模块化、普适性强的纳米疫苗平台 。
潜在的应用前景
该平台的核心优势在于其模块化:由于纳米酶(PVP@Pt)和智能外壳(PEG-b-PAE)是通用的,只需简单替换这个抗原载荷,就可以将该技术快速应用于各种不同肿瘤或传染性疾病的疫苗开发,极大地提升了其转化潜力 。
在未来,这种动态自适应纳米疫苗有望成为下一代亚单位疫苗的主流设计框架 。
当前的局限性与未来的挑战
尽管成果斐然,研究团队也客观地指出了当前的局限性,并提出了未来的优化方向 :
结构参数的微调: 淋巴结靶向效率不仅受粒径影响,还与表面电荷、硬度等参数相关 。未来的研究可以进一步微调PEGylation或引入两性离子涂层来优化淋巴管转运,或者改变颗粒刚度以延长淋巴结滞留 。
主动靶向的集成: 可以考虑引入甘露糖或CD11c抗体等主动靶向配体,进一步增强对DC细胞的特异性摄取,实现更精准的打击 。
安全性和毒理学评估: 作为一个全新的纳米疫苗系统,需要进行全面、长期、系统的毒理学研究来评估其全身安全性,尤其是与免疫激活相关的潜在毒性 。虽然目前在测试剂量下未观察到明显的全身毒性或组织病理学异常 ,但高剂量的安全性仍需深入探索 。
临床前转化: 在进入人体临床试验之前,在大型动物模型上进行进一步的疗效验证是必不可少的步骤 。
通过将这些优化策略(如主动靶向配体、双尺寸系统等)与现有“质子驱动形态调控”及“催化佐剂”相结合,将有望打造出真正无懈可击的下一代自适应纳米疫苗平台 。
这一研究为攻克癌症免疫治疗中的递送与激活瓶颈,提供了“智能”且“高效”的解答,无疑是癌症疫苗领域的一次重大突破 。